はじめに
眼内血管新生は眼科疾患において加齢黄斑変性、近視性脈絡膜新生血管、糖尿病網膜症、未熟児網膜症など失明原因上位に位置する疾患の本態です。新生血管研究グループでは加齢黄斑変性にみられ脈絡膜由来の新生血管である脈絡膜新生血管についての研究を行っています。
加齢黄斑変性について
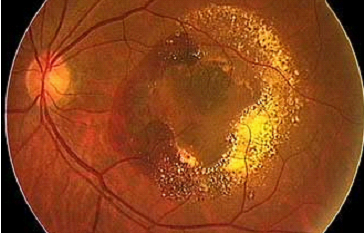
異常発生した脈絡膜新生血管が脈絡膜から網膜色素上皮下あるいは網膜と網膜色素上皮間に侵入し網膜が不可逆的に障害される疾患です(図1)。脈絡膜新生血管は血液成分を漏出、破綻することで重篤な出血を引き起こします。それにより網膜機能を阻害し視力低下をもたらします。唯一の前駆病変として年齢とともに黄斑部網膜色素上皮下にドルーゼンと呼ばれる老廃物が蓄積していきます。それにより直接あるいは間接的に黄斑部が障害されるとされ、近年治療ターゲットとして注目されています。そこで血管新生グループではドルーゼンに含まれる様々な分子に注目し、加齢黄斑変性における脈絡膜新生血管の発生機序の解明、新しい治療法の確立に向けての研究を行っています。
研究内容
脈絡膜新生血管発症における血管新生関連分子メカニズム
脈絡膜新生血管発生には網膜色素上皮細胞から分泌される血管新生促進因子であるVEGFと抑制因子であるPEDFが重要な役割を担っています。我々の研究により加齢黄斑変性発症二おける環境因子の一つである酸化ストレスを培養網膜色素上皮に負荷するとVEGFの発現は上昇しPEDFの発現が低下することから眼内では酸化ストレスにより新生血管促進の環境に傾くことで脈絡膜新生血管が発生することを明らかにしました(1-5)。この研究は今日の加齢黄斑変性における新生血管研究の重要な基礎となっています。
加齢黄斑変性発症におけるアミロイドβの役割
我々研究グループは、アルツハイマー病の原因物質であるアミロイドβがドルーゼン中に含まれることを世界に先駆けて注目し研究を進めています
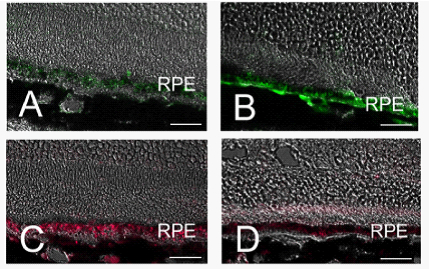
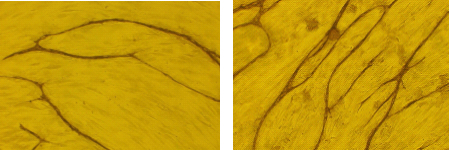
これまで我々はアミロイドβが異常発現するように遺伝子操作したマウスでは網膜色素上皮における血管新生発現促進因子VEGFの発現は亢進し、血管新生抑制因子PEDFの発現は低下していること(図2)、アミロイドβで処理した網膜色素上皮の培養上清は培養血管内皮細胞の増殖を加速することを明らかにし(図3)、アミロイドβが加齢黄斑変性における脈絡膜新生血管発生の原因物質である可能性を示し予防の観点から重要であることを示唆したとともに、脈絡膜新生血管発生後においても治療ターゲット荷なる可能性を示しました(6)。
論文発表
- Ohno-Matsui K, Mori K, Ichinose S, Sato T, Wang J, Shimada N, Kojima A, Mochizuki M, and Morita I. In vitro and in vivo characterization of iris pigment epithelial cells cultured on amniotic membranes. Molecular vision. 2006;12(1022-32.
- Ohno-Matsui K, Ichinose S, Nakahama K, Yoshida T, Kojima A, Mochizuki M, and Morita I. The effects of amniotic membrane on retinal pigment epithelial cell differentiation. Molecular vision. 2005;11(1-10.
- Ohno-Matsui K, Yoshida T, Uetama T, Mochizuki M, and Morita I. Vascular endothelial growth factor upregulates pigment epithelium-derived factor expression via VEGFR-1 in human retinal pigment epithelial cells. Biochemical and biophysical research communications. 2003;303(3):962-7.
- Uetama T, Ohno-Matsui K, Nakahama K, Morita I, and Mochizuki M. Phenotypic change regulates monocyte chemoattractant protein-1 (MCP-1) gene expression in human retinal pigment epithelial cells. Journal of cellular physiology. 2003;197(1):77-85.
- Ohno-Matsui K, Morita I, Tombran-Tink J, Mrazek D, Onodera M, Uetama T, Hayano M, Murota SI, and Mochizuki M. Novel mechanism for age-related macular degeneration: an equilibrium shift between the angiogenesis factors VEGF and PEDF. Journal of cellular physiology. 2001;189(3):323-33.
- Yoshida T, Ohno-Matsui K, Ichinose S, Sato T, Iwata N, Saido TC, Hisatomi T, Mochizuki M, and Morita I. The potential role of amyloid beta in the pathogenesis of age-related macular degeneration. The Journal of clinical investigation. 2005;115(10):2793-800.
- Wang J, Ohno-Matsui K, and Morita I. Cholesterol enhances amyloid beta deposition in mouse retina by modulating the activities of Abeta-regulating enzymes in retinal pigment epithelial cells. Biochemical and biophysical research communications. 2012;424(4):704-9.
- Wang J, Ohno-Matsui K, Yoshida T, Shimada N, Ichinose S, Sato T, Mochizuki M, and Morita I. Amyloid-beta up-regulates complement factor B in retinal pigment epithelial cells through cytokines released from recruited macrophages/microglia: Another mechanism of complement activation in age-related macular degeneration. Journal of cellular physiology. 2009;220(1):119-28.
